Anormalidades genéticas e infertilidade masculina: o que devemos saber?
Cada espécie existente, seja ela animal ou vegetal, possui um conteúdo cromossômico que é responsável pela hereditariedade das características próprias do tipo de organismo estudado. Estes conteúdos são conhecidos como genomas e dão a cada espécie um número característico de cromossomos.
A espécie humana tem seu genoma distribuído em 46 cromossomos, sendo 44 destes autossômicos e 2 sexuais. Muitas vezes, no entanto, por influência de ambiental ou biológica, ocorrem irregularidades na divisão celular, atingindo os cromossomos interfásicos, de modo que pode haver alterações no genoma do indivíduo. Alterações que afetam a estrutura molecular do DNA são chamadas de mutações e mutações de ponto ou mutações pontuais.
Os processos que determinam as modificações estruturais no genoma do indivíduo podem ser de seis tipos básicos: deleções, adições (ou duplicações), inversões (peri e paracêntricas), translocações, trasposições e fissão/fusão cêntricas.
Anormalidades Cromossômicas
As anormalidades cromossômicas acometem 5% dos homens inférteis e esta prevalência chega a 15% nos casos de azoospermia. Anormalidades no cromossomo Y, como microdeleções, são as maiores responsáveis pelos casos de azoospermia (ausência de espermatozóides no ejaculado) e oligospermia grave (menos que 5 milhões de espermatozóides/ml no ejaculado). Portanto, o erros cromossômicos fazem parte de uma importante área de pesquisa na relação entre a genética e infertilidade por fator masculino grave.
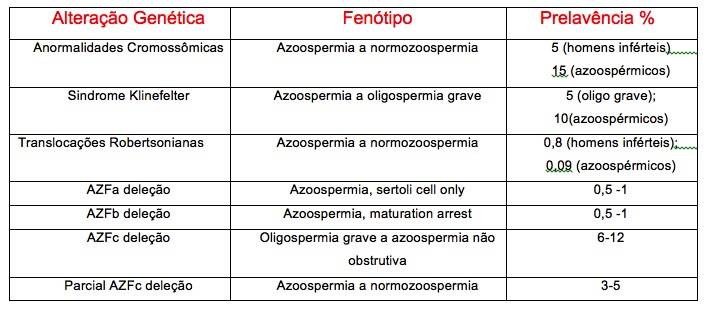
As aneuploidias (número incorreto de cromossomos) formam o grupo mais frequente de alterações cromossômicas nos homens inférteis. Sabe-se que homens azoospérmicos apresentam elevada incidência de aneuplodias, especialmente em seus cromossomos sexuais. A sindrome de Klinefelter é a mais comum alteração cromossômica causada por aneuploidia e tem prevalência que alcança 5% nos homens com oligospermia grave e chega a 15% em azoospérmicos. A sindrome acarreta uma interrupção da espermatogênese ainda no nivel de espermatócito primário, mas ocasionalmente estágios mais maduros da espermatogênese podem ser encontrados.
Existem duas formas de apresentação da doença: não mosaico 47XXY e mosaico 47XXY/46XY. Acredita-se que 25% dos homens não mosaicos podem ter espermatozóides em seu liquido seminal, e dentre os casos de mosaico, ainda resta a possibilidade de existir espermatogênese residual nos túbulos seminíferos, como demonstrado por Foresta et at. em 2005. Homens portadores de sindrome de Klinefelter podem ser beneficiados com técnicas de RA e ICSI, mas o fato de serem portadores de elevado número de gametas aneuplóides, torna-se recomendado que o diagnóstico genético pré-implantacional (PGD) seja realizado de rotina antes da transferência embrionária, para garantir a não transmissão de eventual aneuplodia. Translocações cromossômicas são fonte adicional de aneuploidias. Levam a perda do material genético por rompimentos em locais específicos dos genes, corrompendo desta maneira a informação genética e são encontrados de 4 a 10 vezes mais em homens inférteis, quando comparados com homens férteis. Embora a prevalência de translocações Robersonianas seja de apenas 0,8% nos homens inférteis, esta taxa é nove vezes maior que na população geral. E homens oligospérmicos graves chega a 1,6% de prevalência.
Cromossomo Y
O cromossomo Y compõe importantissima area de interesse no estudo da infertilidade masculina, por conter muitos dos genes cruciais para a espermatogênese e desenvolvimento das gônadas masculinas. As microdeleções no cromossomo Y são frequente causa de infertilidade masculina. São definidas pelo fato de levarem a deleções com perda de inúmeros genes mas não com extensão suficiente para serem detectadas em métodos citogenéticos convencionais. A prevalência de microdeleções no cromosso Y de homens oligospérmicos graves gira em torno de 5% e já em azoospérmicos pode alcançar 10 a 15%. No contexto da reprodução assistida, tais alterações genéticas devem sempre ser debatidas, pois a microdeleções são sempre transmitidas a prole do sexo masculino e as taxas de fertilização e gravidez na ICSI não são afetadas pela presença de microdeleções em regiões específicas do cromossomo Y.
As microdeleções ocorrem habitualmente no braço longo do cromossomo Y – Yq e uma área particular de interesse no Yq é a região associada a azoospermia ( AFZ region – Azoospermia Factor Region), que contém genes associados ao surgimento e desenvolvimento dos espermatozóides e é dividida em sub-regiões denominadas AZFa, AZFb e AZFc.
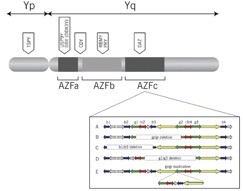
Os dois principais genes contidos na região AZFa são USP9Y e DBY e deleções nesta região, quando acometem ambos os genes, são responsáveis por uma syndrome conhecida com Sertoli-cell only, condição caracterizada por azoospermia e presença apenas de células de Sertoli nos testículos mas ausência completa de células germinativas. Acredita-se que o gene DBY desempenha papel fundamental na espermatogênese, mais importante até que o USP9Y, pois deleções no DBY levam necessariamente a azoospermia. Já microdeleções no USP9Y podem estar associadas a quadros de oligospermia grave ou oligoastenospermia.
Na região AZFb, deleções geralmente repercutem negativamente na espermatogênese por bloquear o processo de desenvolvimento germinativo em fases precoces, como no estágio de espermatócito primário. O gene principal desta região é o RBMY, que codifica uma proteína testículo específica responsável pelo splicing (O Splicing é um processo que remove os íntrons e junta os éxons depois da transcrição do RNA) e expressa no núcleo de espermatozóides, espermatócitos e espermátides. A expressão do gene RBMY é diminuída em homens azoospérmicos.
Já as mutações que ocorrem na região AFZc não são tão graves quanto nas outras regiões do cromossomo Y. Mesmo assim são responsáveis por 12% dos casos de azoospermia e 6% dos casos de oligospermia grave. Homens com deleções nesta região geralmente podem ser pais com auxilio de técnicas de reprodução assistida. Acredita-se que as regiões AZFa e b são responsáveis por iniciar o processo de espermatogênese e a região AFZc pela finalização ou maturação. O gene DAZ possue 4 cópias no braço longo do cromossomo Y e é o mais importante regulador do processo de espermatogênese localizado na região AZFc. Outro gene importante localizado no braço longo do cromossomo Yq e fora das regiões AZF é o gene CDY, que é expresso única e exclusivamente nos testículos e envolvido no processo de substituição dos histonas na espermatogênese. Vale muito e pena lembrar e frizar que os testes clinicos padrões de pesquisa de microdeleção no cromossomo Y não avaliam de rotina o gene CDY.
Mutações Autossômicas e Polimorfismos
Muitos genes autossômicos vem sendo investigados como possíveis fatores promotores de infertilidade masculina. Dentre os principais genes autossômicos envolvidos temos o CFTR, localizado no cromossomo 7 e mutado em 60 a 90% dos pacientes portadores de agenesia congênita deferencial bilateral (CBAVD). A CBAVD leva quadro de azoospermia obstrutiva, por gerar desconexão entre os epidídimos e os ductos ejaculatórios, pela ausência dos ductos deferentes.
O gene SHBG, localizado no cromossomo 17, também vem sendo estudado pelo seu possível papel na espermatogênese masculina. Este gene tem como papel principal controlar o efeito dos hormônios sexuais masculinos sobre os testiculos e consequentemente sua concentração intra-testicular. Sabe-se que niveis adequados de testosterona intra-testicular são necessários para adequada espermatogênese.
Estudos revelando o polimorfismo deste gene, embora pequenos, revelaram que alelos mais curtos do SHBG estavam associados a melhor concentração seminal. Estudos mais amplos e envolvendo outros genes serão necessários para confirmar tal associação. Os genes receptores de estrogênio parecem tambem estar ligados a fertilidade masculina. O ESR1 e ESR2, localizados nos cromossomos 6 e 14 respectivamente, por apresentarem intenso polimorfismo, vêm sendo estudados em busca de possivel relação com espermatogênese.
O gene receptor de FSH (FSHR), localizado no cromossomo 2, esta diretamente relacionado ao bom funcionamento das gônadas masculinas. Estudos preliminares interessantes demostraram diferentes polimorfismos do FSHR quando comparados homens férteis com inférteis.
